Unidad 2
Oxígeno, componente activo del aire
Profundizará en la comprensión de los conceptos básicos de la química, mediante el estudio de reacciones del oxígeno con elementos metálicos y no metálicos, para comprender algunos cambios químicos que suceden a nuestro alrededor.
Explicará la clasificación de los elementos en metales y no metales y la de sus óxidos, por medio de la construcción de modelos operativos de átomos y moléculas, para comprender el comportamiento químico de los elementos.
Reconocerá la importancia de las reacciones de combinación, mediante la obtención óxidos, hidróxidos y oxiácidos, para ilustrar a la síntesis como un proceder propio de la química.
Incrementará las habilidades, actitudes y destrezas propias del quehacer científico, mediante las actividades propuestas, para contribuir a su formación personal y social.
Valorará la importancia de la química en la generación de energía, mediante el estudio de las reacciones de combustión y de su impacto en la naturaleza, para desarrollar una actitud crítica hacia el uso de la tecnología.
Con este material reconocerás y entenderás la importancia del oxígeno en el proceso de reacción con metales y no metales, así como el cambio de éstos en presencia de agua. Dicho proceso, conocido como oxidación, lo podemos observar en las tuberías, en la herrería y es relevante en las industrias de la construcción y marítima, ya que ésta última tiene un gasto de millones de pesos al año para combatirla. La oxidación también tiene que ver con la combustión que usas a diario al calentar alimentos en la estufa ó el agua para bañarte, así como la que ocurre en el motor de los automóviles y, en la síntesis de algunos medicamentos.
Con este material conocerás cómo interactúa el oxígeno ante los metales y no metales para la formación de hidróxidos y ácidos.

Reaccciones de oxígeno
El oxígeno es el elemento más abundante en el planeta Tierra, constituye aproximadamente el 50% en masa de la corteza terrestre y forma el 21% en volumen de la atmósfera; es componente activo del aire, se encuentra presente en el agua y como óxidos con otros elementos. Reacciona tanto con metales como con no metales y, entre los no metales es el segundo en reactividad química, después del flúor.
Existen dos alótropos del oxígeno, el más común es la molécula diatómica O2, el otro es el ozono que es una molécula triatómica, O3.

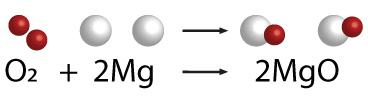
Todo fenómeno químico puede ser representado a través de una ecuación química , que nos muestra los cambios que se llevan a cabo, así podemos describir las variaciones que se realizan cuando se oxidan los elementos metálicosy no metálicos en presencia de oxígeno y con el auxilio de la energía calorífica. A continuación se muestra un ejemplo de cada uno de estos.
Fórmulas de óxidos metálicos
En este ejercicio combinarás los elementos metálicos con el oxigeno para que formes sus óxidos correspondientes.
 Combina los siguientes elementos metálicos con el oxígeno: Co, Ca, K, Al, Cu.
Combina los siguientes elementos metálicos con el oxígeno: Co, Ca, K, Al, Cu. Consulta la tabla periódica para observar su valencia (recuerda que algunos de los elementos tienen dos
Consulta la tabla periódica para observar su valencia (recuerda que algunos de los elementos tienen dosvalencias, elige una) y de acuerdo a su valor combínala para obtener la fórmula del óxido correspondiente. También presta atención en:
- El subíndice (repasa el intercambio de valencias).
- Para el nombre recuerda que se utiliza la palabra genérica “óxido” seguida de la preposición “de” y el nombre del metal con la valencia (entre paréntesis y en números romanos). Revisa el ejemplo que te damos del óxido de cobalto.
- Coloca la fórmula y el nombre en los cuadros correspondientes (escribe los subíndices con números normales. Ejemplo: CO2 quedaría como "CO2").
- Al concluir da clic en el botón Verificar para que compares tus respuestas.

Consulta la tabla periódica.

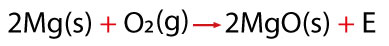
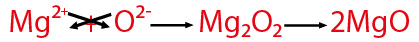
Bien tus ejercicios espero que te sirvan para reafirmar tus aprendizajes
ResponderEliminar